INTRODUCCIÓN
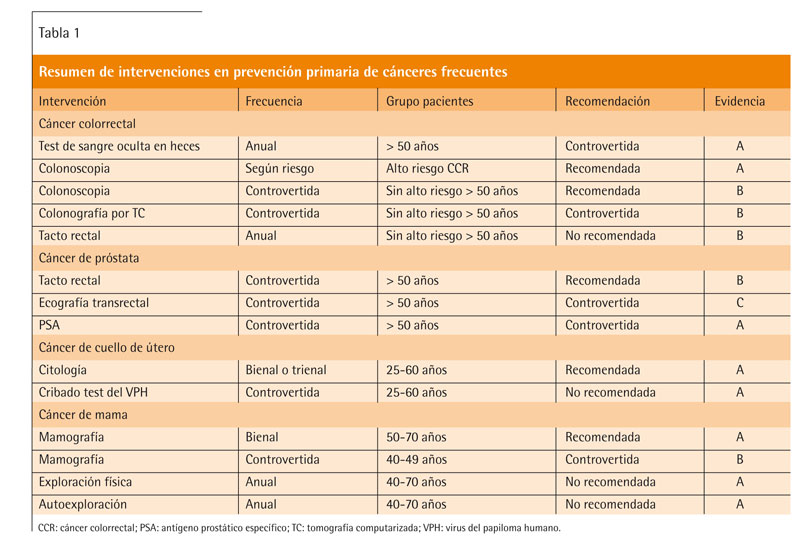
La atención primaria desempeña un papel fundamental en el diagnóstico precoz del cáncer. En general, el diagnóstico en estadios precoces mejora la supervivencia y aumenta la efectividad de los tratamientos. Por esta razón, se han propuesto diversas medidas de cribado poblacional de cáncer. Sin embargo, en ocasiones no somos conscientes de que no siempre el diagnóstico precoz mejora la supervivencia y de que toda prueba de cribado tiene potenciales efectos adversos, especialmente en forma de falsos positivos y la consiguiente yatrogenia médica. En este artículo revisaremos las evidencias disponibles sobre el impacto en términos de salud de diversas estrategias de cribado poblacional para cuatro tipos de cáncer: colorrectal, de próstata, de mama y de cuello de útero. El resumen de las recomendaciones puede consultarse en la tabla 1.
Como el lector atento podrá apreciar, muchas de estas medidas son controvertidas por lo que probablemente sea inadecuado aplicar reglas generales sencillas. La aplicación en el paciente concreto de las evidencias científicas obtenidas en estudios poblacionales no es tarea sencilla y requiere que el médico de familia aplique su arte y su ciencia para ayudar al paciente a tomar una decisión lo más informada posible.
CÁNCER COLORRECTAL
El cáncer colorrectal (CCR) es la tercera neoplasia maligna más común en el mundo1. En España, murieron 13.434 personas por CCR en 2007. La mayoría de los casos se diagnostican en pacientes mayores de 50 años; sólo un 7% de los CCR ocurren antes de esa edad2. Entre los grupos que tienen una mayor incidencia de CCR se encuentran aquellos con enfermedades hereditarias, como la poliposis adenomatosa familiar, el CCR hereditario no poliposo o la enfermedad intestinal inflamatoria crónica de larga evolución. Sin embargo, todos estos grupos de riesgo constituyen sólo una cuarta parte de los CCR; la mayoría CCR no pertenecen a grupos de riesgo conocido3.
Se cree que la mayoría de los CCR surgen a partir de pólipos adenomatosos4, por lo que la detección temprana y el tratamiento de esos pólipos puede disminuir la mortalidad por CCR. Sin embargo, existe mortalidad asociada a lesiones de rápido crecimiento o no precedidas por adenomas. La tasa de crecimiento de estos pólipos precursores de CCR es muy variada y poco comprendida e incluye la regresión espontánea de algunos adenomas5.
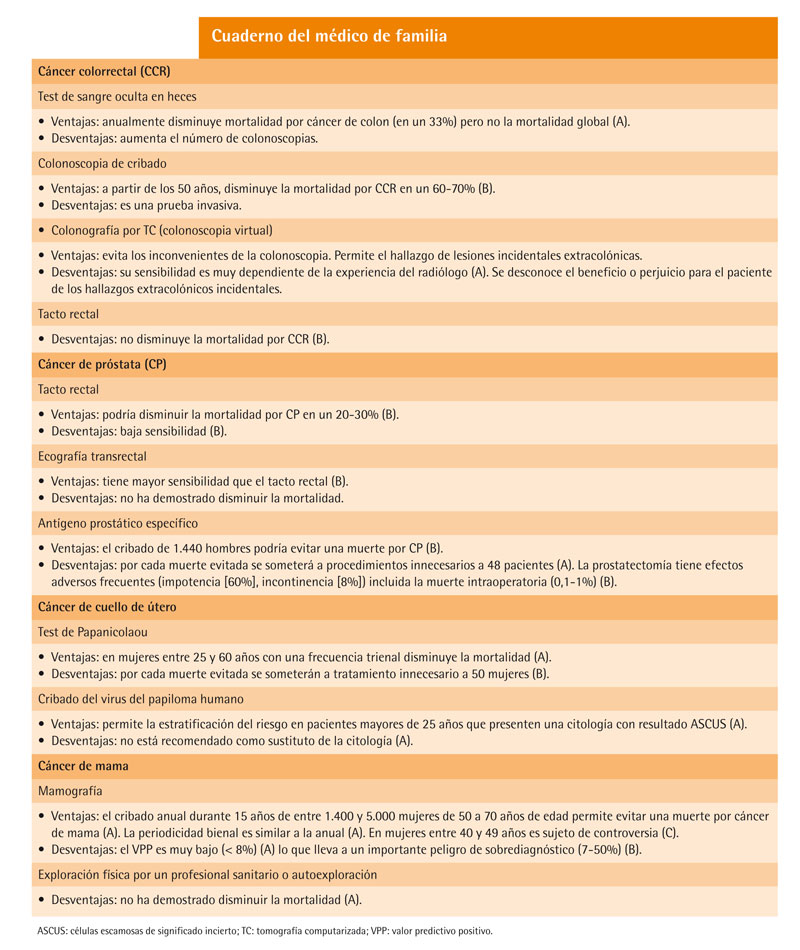
Cribado mediante test de sangre oculta en heces (TSOH)
Diversos ensayos clínicos han evaluado la eficacia del cribado mediante TSOH. Uno de ellos demostró una disminución del riesgo de muerte por CCR en un 33% con respecto al grupo control en el caso de cribado anual6, y de un 21% en el caso de realizar el test cada 2 años7. Esta reducción se asoció con un aumento de las colonoscopias realizadas por lo que no resulta sencillo aislar el impacto del TSOH sobre los resultados. Otros ensayos clínicos han confirmado la disminución del riesgo de muerte por CCR en el grupo sometido a cribado con TSOH (Odds Ratio [OR] = 0,85) aunque al analizar la mortalidad global por todas las causas no se encontraron diferencias8,9. Una revisión publicada por la colaboración Cochrane en 2008 mostró similares conclusiones10 .
Colonoscopia
No existen hoy evidencias provenientes de ensayos clínicos controlados que analicen el impacto del cribado mediante colonoscopia sobre la reducción de la mortalidad por CCR, aunque hay algunas evidencias indirectas sobre su utilidad en la detección precoz de lesiones. La presencia de pólipos adenomatosos en forma de neoplasia avanzada (diámetro mayor de 10 mm, adenoma velloso, adenoma con displasia de alto grado o cáncer invasivo) en la población es un hallazgo relativamente común. En un estudio realizado en Varsovia sobre 43.000 pacientes con edades comprendidas entre 50 y 66 años sometidos a colonoscopia de cribado, se observó una prevalencia de neoplasias avanzadas del 5,9% (5,7% en mujeres con antecedentes familiares de CCR, 4,3% en mujeres sin antecedentes familiares, 12,2% en hombres con antecedentes familiares y 8,0% entre hombres sin antecedentes)11 .
En cuanto a la reducción de la mortalidad, algunos datos de estudios de casos y controles sugieren que podría esperarse una reducción de la mortalidad de entre el 60 y el 70%12. Merece la pena destacar las discrepancias encontradas en estos estudios en reducción de la mortalidad entre CCR del hemicolon izquierdo (OR = 0,33) y del hemicolon derecho (donde no se observa reducción de mortalidad). Actualmente hay un ensayo clínico controlado en marcha que permitirá elucidar el papel de la colonoscopia en la reducción de la mortalidad por CCR con mayor fiabilidad13 .
Colonoscopia virtual (colonografía por TC)
La colonoscopia virtual se ha propuesto como una alternativa a la colonoscopia de cribado, con una sensibilidad del 90%, una especificidad del 86% y un valor predictivo positivo (VPP) del 23%, siendo la colonoscopia convencional la técnica de referencia de comparación. Sin embargo, el estudio tenía algunas limitaciones metodológicas que limitan su generalización14 .
Un metaanálisis mostró que la sensibilidad de la colonoscopia virtual se veía ampliamente influida por la experiencia de los radiólogos y las características técnicas de la tomografía computarizada (TC). La especificidad era más estable15 .
Existen numerosas dudas sobre los posibles efectos indeseables de la realización de colonoscopias virtuales de cribado. Por ejemplo, entre el 8,6 y el 69% de los pacientes sometidos a esta prueba muestra hallazgos extracolónicos incidentales (renales, ováricos u otros) que obligan a la realización de más pruebas sin que se conozca si este hecho beneficia o daña a los pacientes16-19 .
Tacto rectal
La realización de tactos rectales de cribado no disminuye la mortalidad por CCR20 .
CÁNCER DE PRÓSTATA
La biología y la evolución natural del cáncer de próstata (CP) es poco comprendida y muy variable. Se estima que la mayor parte de las lesiones preneoplásicas permanecen estables y no producirán la muerte del paciente21. En España, en 2007, murieron 5.584 hombres por CP.
Tacto rectal
El tacto rectal es una técnica sencilla, poco invasiva y fácil de aprender. Sin embargo, su efectividad depende de la experiencia del examinador. Su papel como cribado del CP no ha sido adecuadamente determinado. El VPP para el diagnóstico de cáncer en la palpación de un nódulo en la próstata durante el tacto rectal es del 25% (en una pequeña serie de 811 pacientes)22. Sin embargo, el 25% de los pacientes con cáncer en fase metastásica tienen un tacto rectal normal23. Estudios de casos y controles sugieren una reducción del riesgo de muerte por CP del 20 al 30%24 mientras que otros no encontraron ninguna reducción en el riesgo de sufrir CP metastásico25. En definitiva, la calidad de estas evidencias es escasa y no permite obtener conclusiones definitivas.
Ecografía transrectal
El uso de la ecografía transrectal en el cribado de cáncer de próstata ha mostrado una sensibilidad mayor que el tacto rectal (71-92% para carcinoma). El rango de especificidad oscila entre el 49 y el 79%, con un valor predictivo en torno al 30%26,27. Sin embargo, no está claro hasta qué punto el incremento de la detección de estos carcinomas, al aumentar la sensibilidad, mejoraría la supervivencia.
Determinación del antígeno prostático específico (PSA)
El uso de los niveles de PSA en sangre periférica se ha estudiado como cribado inicial y de detección de recurrencias tras el tratamiento para el carcinoma de próstata con una sensibilidad estimada en torno al 70%28 .
Se ha propuesto el valor de 4,0 ng/ml como punto de corte, aunque en realidad sea difícil de establecer dicho valor pues lo que hay es una distribución del riesgo de cáncer de próstata para todos los valores de PSA. En un estudio publicado en el 2004, el 15,8% de los pacientes con niveles iguales o inferiores a 4,0 ng/ml tenían cáncer de próstata en sus biopsias, el 2,4% tenían un carcinoma de alto grado (Gleason ≥ 7)29 .
Aunque el uso del PSA ha aumentado la detección de cánceres de próstata en fases tempranas, permitiendo el tratamiento local, en algunos casos estos cánceres no requerirían tratamiento alguno30-33, por lo que existe un riesgo no despreciable de sobrediagnóstico y sobretratamiento34,35,36.
La medición del PSA tiene otras limitaciones como, por ejemplo, la variabilidad en la concentración del antígeno a lo largo del tiempo. Entre un 63 y un 83% de los pacientes con un PSA elevado revertirán a niveles normales espontáneamente en 1 año37 .
Un ensayo clínico realizado en 76.693 pacientes no mostró, a los 10 años de seguimiento, diferencias entre la mortalidad por cáncer de próstata y la mortalidad por todas las causas entre los pacientes que se sometieron a cribado mediante PSA con respecto a los que se sometieron a un cribado mediante tacto rectal38. Otro ensayo clínico realizado en 162.243 pacientes entre 50 y 74 años sí mostró una reducción en la mortalidad por cáncer de próstata en el grupo sometido a cribado por PSA con respecto al grupo control que no recibió ningún tipo de cribado. Estas diferencias en mortalidad se observaron a partir del séptimo año y consistían en una reducción del riesgo absoluta de 0,71 por 1.000 (reducción del 20% del riesgo relativo). La conclusión del estudio fue que es necesario someter a cribado mediante PSA a 1.440 hombres para evitar 1 muerte por cáncer de próstata. Como consecuencia, de estos 1.440 pacientes, 48 serían sometidos a tratamientos innecesarios39 .
La biopsia prostática se asocia con complicaciones frecuentes como fiebre, dolor, hematospermia, hematuria o infección urinaria. El riesgo de sepsis es del 0,4%4042. Las complicaciones a largo plazo de la prostatectomía radical incluyen incontinencia urinaria, estenosis uretral, disfunción eréctil, incontinencia fecal y la morbilidad asociada a cirugía mayor. La mortalidad oscila entre un 0,1 y un 1%. En un estudio, el 8,4% de los pacientes mostraron incontinencia y el 60%, impotencia a los 2 años de la prostatectomía43 .
Se desconoce la frecuencia óptima de cribado mediante PSA44-46. El 8% de los hombres con un nivel de PSA inferior a 1 ng/ml fue diagnosticado de cáncer de próstata en los 2 años siguientes en un ensayo clínico47 .
Informes preliminares de un ensayo clínico europeo muestran que aunque un cribado más frecuente produce más diagnósticos de cáncer, la detección de cánceres agresivos fue similar entre los grupos de cribado cada 2 y 4 años48 .
CÁNCER DE CUELLO DE ÚTERO
En España murieron 629 mujeres por cáncer de cuello de útero en 2007. Aunque la cifra no es de gran magnitud, la importancia de este cáncer radica en que el diagnóstico precoz permite el tratamiento efectivo en la mayoría de los casos.
El carcinoma escamoso invasivo del cuello de útero se produce tras la progresión de lesiones preinvasivas denominadas «neoplasias cervicales intraepiteliales» (CIN) o displasias, clasificadas según su grado histológico en CIN-1 (leve), CIN-2 (moderada) y CIN-3 (grave). Muchas de las lesiones leves y moderadas desaparecen por sí solas. El sistema de clasificación de Bethesda ha sustituido a esta clasificación, mediante el uso de criterios citológicos: células escamosas de significado incierto (ASCUS), lesiones escamosas intraepiteliales de bajo grado equivalentes a un CIN-1, y lesiones escamosas intraepiteliales de alto grado equivalentes a CIN-2, CIN-3 y carcinoma in situ.
Aproximadamente, el 70% de las lesiones ASCUS y CIN-1 desaparecen por sí solas en el plazo de 6 años, mientras que el 6% de las CIN-1 progresan a CIN-3. Entre un 10 y un 20% de las mujeres con lesiones CIN3 desarrollan un cáncer invasivo49-51 .
Cribado con citología de cuello uterino (test de Papanicolaou)
El test de Papanicolaou nunca ha sido estudiado en un ensayo clínico controlado. Sin embargo, existen datos sólidos de que reduce la mortalidad por cáncer de cuello de útero hasta en un 80%. Esta reducción en la incidencia y la mortalidad es proporcional a la intensidad del cribado52. Los beneficios en mujeres menores de 25 años son pequeños debido a la baja prevalencia de la enfermedad en este grupo de edad. El cribado no beneficia a mujeres mayores de 60 años con citología previa negativa reciente, ni a mujeres sin cuello de útero debido a una histerectomía secundaria a patología benigna53,54.
El cribado cada 2 o 3 años no aumenta el riesgo de detectar el cáncer en fases invasivas de forma significativa al compararlo con el cribado anual54 .
Existen evidencias sólidas de que el cribado repetido mediante citología conduce a procedimientos diagnósticos adicionales (colposcopia) así como a tratamientos para lesiones de bajo grado que tienen una regresión espontánea en la mayoría de los casos; este exceso de tratamientos innecesarios afecta a la fertilidad a largo plazo, en especial a las mujeres más jóvenes, por su mayor prevalencia de lesiones de bajo grado y su mayor probabilidad de falsos positivos. En un estudio, el 50% de las citologías se siguieron de pruebas diagnósticas adicionales, de las cuales aproximadamente 1 de cada 20 recibieron tratamiento por presentar una lesión de bajo grado. El impacto real sobre la fertilidad y el embarazo es una posibilidad teórica aunque se desconoce su magnitud real. Algunos modelos sugieren que para prevenir una muerte sería necesario someter a cribado durante 35 años a 1.000 mujeres. Por cada muerte evitada, 150 mujeres tendrían un falso positivo, 80 serían sometidas a más pruebas y 50 recibirían tratamientos innecesarios55 .
Cribado de la presencia del virus del papiloma humano (VPH)
Prácticamente la totalidad de las mujeres con cáncer de cuello de útero invasivo muestran evidencias de infección por VPH56. Sin embargo, la mayoría de las mujeres con infección por VPH jamás desarrollarán cáncer de cuello de útero; por lo tanto, aunque la infección es necesaria, no es causa suficiente para el desarrollo de cáncer de cuello de útero57 .
Existe un test de detección de ADN del VPH diseñado para la detección de 13 de los 15 genotipos relacionados con el cáncer de cuello de útero. Sin embargo, la infección por VPH carcinogénico es muy común entre las mujeres sexualmente activas y en la mayoría de los casos dicha infección desaparece en 2 años. No existen evidencias claras que demuestren la utilidad del cribado del VPH en la reducción de la mortalidad por cáncer de cuello de útero. El test de detección VPH ha demostrado una mayor sensibilidad en la detección de CIN-2 o superior que el test de Papanicolaou en mujeres mayores de 30 años (95 frente al 55%)58 aunque la menor especificidad del test de VPH (94 frente al 97% para el test de Papanicolaou) hace que existan dudas sobre la idoneidad de su uso para el cribado primario59 . Un ensayo clínico controlado demostró la utilidad, en términos de coste-efectividad, de la detección del VPH en mujeres con resultado citológico clasificado como ASCUS para la estratificación del riesgo60. Sin embargo, la detección del VPH no está recomendada en adolescentes que presenten ASCUS pues la mayoría de estas pacientes están infectadas por el VPH61 .
CÁNCER DE MAMA
El cáncer de mama es el cáncer más frecuente en Europa. En España murieron 5.983 mujeres por cáncer de mama en 2007. El diagnóstico precoz es importante y mejora la supervivencia a 5 años, situada actualmente en un 83% en España62 .
Mamografía
La sensibilidad global de la mamografía es de un 79% y su especificidad, del 90%. Ambas son menores en mujeres jóvenes (incluidas aquellas entre 40 y 49 años)63 o las mujeres con tejido mamario de mayor densidad64-66. La sensibilidad depende, en gran medida, de la experiencia del radiólogo que interpreta la mamografía67-76 .
Las neoplasias con histología mucinosa o lobulillar, de alto grado histológico y gran actividad proliferativa, en mujeres menores de 50 años, son las más difíciles de detectar mediante cribado mamográfico77. Los cánceres detectados mediante cribado por mamografía tienen mejor pronóstico incluso al ajustar por tamaño y estadificación tumoral. Esto ocurre porque sus características histológicas son favorables, incluyendo bajo grado histológico, mayor sensibilidad hormonal y menores índices proliferativos. Es decir, la forma de detección del cáncer de mama (por cribado mamográfico o por otros métodos) es un factor predictivo independiente de mortalidad (HR = 1,9 para cánceres no detectados en cribado)78 .
Se desconoce el intervalo óptimo para el cribado con mamografías. En un ensayo clínico con mujeres entre 50 y 62 años no se observaron diferencias entre el grado y la estadificación de los cánceres detectados con mamografías anuales o trienales, aunque en el grupo anual el tamaño del tumor era ligeramente menor79. Otro estudio observacional mostró que en mujeres entre 40 y 49 años el cribado cada 2 años, comparado con el cribado anual, se asociaba con la detección de cánceres en fases más avanzadas (OR = 1,35). Sin embargo, en mujeres mayores de 50 años no se observaron diferencias80. En general, los cánceres que aparecen en el intervalo entre una mamografía y otra tienen características de crecimiento rápido y se detectan en fases avanzadas77,81.
El beneficio del cribado mediante mamografía es un tema sujeto a un intenso debate científico. Es difícil estimar este beneficio82 debido a que en los resultados de los distintos ensayos clínicos realizados influyen diversos factores externos83-92 .
Algunos autores han realizado modelos basados en metaanálisis para estimar el número de muertes retrasadas gracias a la detección temprana del cáncer de mama. Se estima que, si se somete a 10.000 mujeres de entre 50 y 70 años a un cribado por mamografía, se obtendrán entre 466 y 479 falsos positivos por los que entre 100 y 200 mujeres serán sometidas a procedimientos invasivos. Se detectarán entre 21 y 34 cánceres de mama (verdaderos positivos) de los cuales entre 2 y 6 responderán adecuadamente al tratamiento. Expresado de otra forma, se estima que el cribado anual durante 15 años de 1.700 a 5.000 mujeres consigue retrasar una muerte. De aplicarse esta medida en mujeres entre 40 y 49 años, se detectarían 12 cánceres y 488 falsos positivos. De estos 12 cánceres de mama detectados, sólo uno o dos responderían al tratamiento93 .
En cuanto a la periodicidad del cribado con mamografía, algunos modelos matemáticos estiman que realizar la mamografía cada 2 años en vez de anualmente permite mantener el 81% del beneficio del cribado reduciendo a la mitad el número de falsos positivos94 .
Debido a la baja prevalencia de cáncer de mama en el momento del cribado, la mayoría de las mamografías informadas como positivas son en realidad falsos positivos95. En un estudio realizado sobre 2.400 mujeres sometidas a mamografía anual durante 10 años el 7,8% de ellas fue sometida a una biopsia, la mayoría de ellas innecesarias. El 69% de las biopsias fueron negativas. El VPP en esa población fue de sólo el 6,3% para mujeres entre 40-49 años, del 6,6% para mujeres entre 50-59 años y del 7,8% para mujeres entre 60-69 años96. Las posibilidades acumuladas de tener una mamografía con un resultado falso positivo son del 7,4% en la primera mamografía, del 26% en la quinta mamografía y del 43% en la novena mamografía97. Otros estudios han mostrado resultados similares (VPP = 8%)98 .
El beneficio de una mamografía anual supera a los riesgos potenciales secundarios a la exposición a radiaciones ionizantes99 .
Hasta un 25% de las mujeres que sufrieron un resultado falso positivo en la mamografía presentaban síntomas de ansiedad o alteración en el estado de ánimo a los 3 meses de ser comunicado el resultado, pese a que se hubiese comunicado la benignidad del hallazgo100. Sufrir un resultado falso positivo aumenta la participación en futuros cribados y la frecuencia con la que las pacientes se someten a nuevas mamografías, lo que indica un impacto psicológico duradero101-104.
En toda prueba de cribado existe cierto riesgo de sobrediagnóstico, es decir, la detección de cánceres de mama indolentes, de crecimiento lento o de regresión espontánea, que nunca hubiesen producido morbilidad ni mortalidad a las pacientes. Existe controversia acerca de la magnitud de ese sobrediagnóstico en el cáncer de mama debido a limitaciones metodológicas pero se estima que se encuentra entre un 7-50% 105-114.
Cribado mediante exploración clínica
Se ha propuesto como método de cribado la exploración física de las mamas por un profesional sanitario, aunque no existen ensayos clínicos que la evalúen como método único. Un estudio que comparó el uso de mamografía con la mamografía combinada con exploración física no encontró diferencias en mortalidad por cáncer de mama115 .
En exploraciones realizadas por médicos generales, la sensibilidad oscila entre un 22-36% y la especificidad, entre un 97-99%. Comparado con la exploración realizada en unidades especializadas, la sensibilidad en atención primaria es menor (22 frente al 71%) y la especificidad, mayor (97 frente al 84%). El VPP en unidades especializadas está entre el 1,5 y el 4%. La duración de la exploración en estos estudios fue de 5 a 10 minutos por mama116-120 .
Autoexploración mamaria
Un ensayo clínico realizado con 266.064 mujeres demostró que la autoexploración mamaria no disminuye la mortalidad por cáncer de mama, ni aumenta el número de cánceres de mama invasivos diagnosticados, aunque sí incrementa el número de biopsias y lesiones benignas diagnosticadas121 .
RESUMEN
Revisamos en este artículo las evidencias disponibles sobre el cribado poblacional de distintos tipos de cáncer. En el cáncer colorrectal, existen evidencias que apoyan la realización de colonoscopia de cribado en pacientes con alto riesgo y en mayores de 50 años. El tacto rectal no está recomendado, el uso de test de sangre oculta en heces y la colonoscopia virtual son controvertidos. En el cáncer de próstata, el uso de cribado mediante antígeno prostático específico (PSA) y la ecografía transrectal son controvertidos, se recomienda el tacto rectal a partir de los 50 años. En el cáncer de cuello de útero, está recomendada la citología bienal o trienal en mujeres entre 25 y 60 años, pero no está recomendado el cribado poblacional mediante la prueba del virus del papiloma humano (VPH). En el cáncer de mama, está recomendada la mamografía bienal entre los 50 y 70 años; entre los 40 y 49 años existen controversias. No está recomendado el cribado mediante exploración física o autoexploración mamaria. La aplicación en el paciente concreto de las evidencias científicas obtenidas en estudios poblacionales no es tarea sencilla y requiere que el médico de familia aplique su arte y su ciencia para ayudar al paciente a tomar una decisión lo más informada posible.
LECTURAS RECOMENDADAS
OncoGuía de próstata. Barcelona: Agència d’Avaluació de Tecnologia i Recerca Mèdiques. CatSalut. Departament de Sanitat i Seguretat Social. Generalitat de Catalunya. Noviembre 2004 (OG02/2004) [acceso 19 de septiembre de 2010]. Disponible en: http://www.gencat.cat/salut/depsan/pdf/og0402es.pdf
OncoGuía de colon y recto. Barcelona: Agència d’Avaluació de Tecnologia i Recerca Mèdiques. CatSalut. Departament de Sanitat i Seguretat Social. Generalitat de Catalunya. Noviembre 2003 (OG03/2003) [acceso 19 de septiembre de 2010]. Disponible en: http://www.gencat.cat/salut/depsan/pdf/og0303es.pdf
OncoGuía de mama. Barcelona: Agència d’Avaluació de Tecnologia i Recerca Mèdiques. CatSalut. Departament de Sanitat i Seguretat Social. Generalitat de Catalunya. Noviembre 2003 (OG04/2003) [acceso 19 de septiembre de 2010]. Disponible en: http://www.gencat.cat/salut/depsan/pdf/og0304es.pdf
Oncoguía SEGO: Cáncer de Cuello Uterino 2008. Guías de práctica clínica en cáncer ginecológico y mamario. Publicaciones SEGO, Octubre 2008 [acceso 19 de septiembre de 2010]. Disponible en: http://www.upmamaria.net/Protocolos/CervixMamaOncoguia2008.pdf
BIBLIOGRAFÍA
Podrá encontrar todas las referencias bibliográficas de este artículo en el apartado "Ampliación de información"
CUADERNO DEL MÉDICO DE FAMILIA